Gynäkologie - Gutartige Erkrankungen - PCO-Syndrom
Zunächst ein Hinweis in eigener Sache:
Immer wieder möchten Patientinnen weite Anfahrtswege in Kauf nehmen um sich bezüglich des PCO-Syndroms in meiner Praxis beraten zu lassen. Ich bin allerdings kein Gynäkologe mit einem endokrinologischen Schwerpunkt und rate deshalb von einem solchen Vorgehen ab!
Einleitung;
Von einem PCO-Syndrom, dem Syndrom der polyzystischen Ovarien, sind etwa 5-10 % der Frauen in Mitteleuropa betroffen. Es handelt es sich um eine der häufigsten endokrinen Störungen (Krankheiten, bei denen hormonelle Störungen ursächlich und krankheitsbestimmend im Vordergrund stehen) im fortpflanzungsfähigen Alter.
Definition:
Es gibt verschiedene Definitionen für das PCO-Syndrom. Beispielsweise nach dem Rotterdam Consensus Workshop 2003 wird das PCO-Syndrom (PCOS) folgendermaßen definiert: (2 von 3 Kriterien müssen erfüllt sein)
- Zyklusstörungen mit Oligomenorrhoe und/oder Amenorrhoe
- Klinische und/oder biochemische Zeichen der Hyperandrogenämie
- Polyzystische Ovarien
Die
Oligomenorrhoe beschreibt eine zu seltene Menstruationsblutung mit einem Zyklusintervall zwischen 36 und 89 Tagen drei Jahre nach der Menarche. Bleiben die Blutungen für mindestens 3 Monate aus, spricht man von einer
Amenorrhoe. Bis zu einem Jahr nach der Menarche ist ein unregelmäßiger Zyklus normal. Zwischen dem ersten und dritten Jahr nach Menarche ist ein Zyklus nur dann als auffällig anzusehen, wenn er kürzer als 21 oder länger als 45 Tage dauert.
Hyperandrogenämie ist eine allgemeine Bezeichnung für erhöhte Androgenkonzentrationen im Blut. Sie ist in bis zu 50 % ursächlich für eine Oligo- oder Amenorrhoe.
Der Begriff "Polyzystische
Ovarien" bedeutet übersetzt ein Eierstock mit vielen Eibläschen. Ein anderer Ausdruck dafür lautet "Polyfollikuläre Ovarien", abgekürzt PFO.
Dabei müssen alle anderen Ursachen für eine Hyperandrogenämie ausgeschlossen sein (z. B. Cushing-Syndrom,
Hyperprolaktinämie, Androgen-produzierende Tumoren des Eierstocks oder der Nebennierenrinde, pharmakologische Androgenisierung, z. B. durch Einnahme von Anabolika). In 95 % der Fälle ist die Ursache allerdings ein PCO-Syndrom oder idiopathisch.
Ursachen:
Es wird angenommen, dass zwei Genvarianten die biomolekulare Basis für das PCO-Syndrom darstellen. Der Hintergrund kann eine genetisch bedingte sogenannte Insulinresistenz mit erhöhten Insulinwerten im Blut sein. Die Hyperandrogenämie ist dann Folge eines LH-Effektes auf die Eierstöcke, welche ihre Androgenproduktion steigern. Weitere Folgen für den Stoffwechsel sind in diesem Fall häufig Übergewicht, eine Fettstoffwechselstörung und Diabetes mellitus. Die zweite Variante ist eine Veränderung in einem sogenannten P450-C17-a-Gen. Sie führt zu einer gesteigerten Androgenbildung in den Eierstöcken und Nebennieren.
Klinik:
Im Falle von Hyperandrogenämie sind klinische Zeichen die Akne, Hirsutismus und eine typische androgenetische/hyperandrogenämische Alopezie.
Bei einer
Akne weist die Haut zahlreiche Mitesser und mehr oder weniger stark entzündete Knötchen auf.
Als
Hirsutismus wird eine verstärkte, dem männlichen Behaarungstyp entsprechende, Behaarung bei Frauen verstanden.
Von verstärktem
Haarausfall (Effluvium) wird gesprochen, wenn täglich mehr als 100 Haare ausfallen. Es ist sehr häufig visuell nicht objektivierbar. Alopezie beschreibt einen sichtbaren Haarverlust im Bereich der Kopfhaut. Bei einer sogenannten
androgenetischen/hyperandrogenämischen Alopezie der Frau lichtet sich das Haar entlang des Scheitels, die Haardichte im Bereich von Schläfen und Hinterkopf bleibt normal.
Manche Frauen entwickeln aufgrund genetisch bedingter Unterschiede in der Empfindlichkeit der Zellen auf männliche Hormone nie die typischen Androgenisierungserscheinungen, während andere trotz eines Hirsutismus oder einer Alopezie (fast) normale Androgenwerte im Blut aufweisen. Bei Hirsutismus können sogar alle anderen Symptome fehlen und der Menstruationszyklus sowie die Fruchtbarkeit unbeeinflusst bleiben. Eine Schlüsselrolle bei der Entstehung von Alopezie und Hirsutismus spielt die Aktivität eines Enzyms im Haarbalg, welches Testosteron in seine aktive Form, das 5α-Dihydrotestosteron (DHT), umwandelt. Bei einer erhöhten Aktivität des Enzyms können die Symptome trotz nicht oder nur grenzwertig erhöhter Testosteronwerte ausgeprägt sein. Deshalb wird bei der Alopezie auch unterschieden zwischen einer androgenetischen Alopezie mit normalen Testosteronwerten und einer hyperandrogenämischen Alopezie mit erhöhten Testosteronwerten.
Übergewichtige Frauen mit PCO-Syndrom weisen in typischer Weise nach ihrem Fettverteilungsmuster eine sogenannte androide (viszerale)
Adipositas (Fettsucht) mit einem Taillenumfang über 80 cm auf, der Hüftumfang ist kleiner (Apfelform). Die androide Adipositas gilt als eine der wichtigsten Risikofaktoren in der Entstehung von Atherosklerose, Herzinfarkt und Diabetes mellitus, beschrieben als
Metabolisches Syndrom oder auch Syndrom X. Im Unterschied zur androiden Adipositas weist eine gynoide Adipositas ein weibliches Fettverteilungmuster mit Betonung der Hüften auf, auch periphere oder gluteofemorale Adipositas bzw. "Birnentyp" genannt.
Folge der polyzystischen Ovarien sind
Zyklusstörungen. Nur selten oder nie kommt es zu einem Eisprung. Es bleibt somit auch die sekretorische Umwandlung der Gebärmutterschleimhaut aus (siehe
Zyklus & Hormonspiegel). Die Patientinnen sind über lange Zeit hohen Östrogenspiegeln ausgesetzt, entwickeln oft starke sogenannte Durchbruchblutungen und haben langfristig ein erhöhtes Risiko für einen
Brustkrebs und einen
Gebärmutterschleimhautkrebs.
Hinweis: Das Risiko für einen Gebärmutterschleimhautkrebs ist hierbei um das 2- bis 6-fache erhöht, die Inzidenz des Krebsleidens jedoch insgesamt gering. Bei Zyklen länger als 90 Tage sollte jedoch eine Transformation der Gebärmutterschleimhaut z. B. mit Chlormadinonacetat durchgeführt werden.
Diagnostik:
Polyzystische Ovarien: Die Definition der polyzystischen Ovarien ist uneinheitlich. Ein häufig gebrauchter Richtwert basiert auf einer Ultraschalluntersuchung mit Feststellung von
mehr als 20 Follikeln in einem Eierstock und/oder einem
vergrößerten Volumen des Eierstocks (Längs- x Quer- x Tiefendurchmesser x 0,5)
von mehr als zehn Millilitern. Die volle gynäkologische Reife ist jedoch
erst acht Jahre nach der Menarche erreicht. Erst zu diesem Zeitpunkt kann wegen des physiologischen Auftretens multifollikulärer Ovarien in der frühen Adoleszenz Ultraschalldiagnostik empfohlen werden.
Akne: Einteilung nach ihrem Schweregrad in drei Formen
- Leicht (Acne comedonica): viele Mitesser (Komedonen), die sich aber nur selten entzünden
- Mittelschwer (Acne papulopustulosa): zahlreiche gerötete Knötchen und Eiterbläschen neben Mitessern
- Schwer (Acne conglobata): viele, oft sehr dicke, eitrig entzündete Bläschen (furunkelartig)
- Stadium I: beginnende Haarlichtung in der Scheitelregion, frontaler Haarsaum von 1-3 cm Breite
- Stadium II: deutliche Haarlichtung im Scheitelbereich
- Stadium III: ausgeprägte Haarlichtung im Bereich vorne und seitlich, der vordere Haarsaum bleibt bestehen
| Auswertung für weibliche Erwachsene: | |
| Gewicht: | BMI [Gewicht in kg/(Größe in Meter²)]: |
| Normalgewicht | 18,5 - 24,9 |
| Übergewicht | 25,0 - 29,9 |
| Adipositas Grad I | 30,0 - 34,9 |
| Adipositas Grad II | 35,0 - 39,9 |
| Adipositas Grad III | ≥ 40 |
Endokrine Veränderungen:
Der Hyperandrogenämie kann grundsätzlich eine Störung der
Hormonproduktion im Eierstock (Ovar) oder in der Nebenniere (Adren) zugrunde liegen. Ein
hoher LH-Wert und erhöhter Testosteronspiegel sind dabei kennzeichnend für eine vorwiegend
ovarielle Ursache. Die Basisdiagnostik umfasst die Bestimmung von mehreren Hormonwerten im Blut, nämlich
Testosteron, SHBG, TSH und Prolaktin. In Einzelfällen können auch noch LH, FSH, Androstendion, DHEAS, Dihydrotestosteron (DHT) und AMH bestimmt werden. Bei einem PCO-Syndrom ist typischerweise zwischen dem 2. und 4. Zyklustag LH > FSH.
Die Androgene werden durch die Einnahme von Antibabypillen beeinflußt. Für eine zuverlässige Beurteilung sollten Präparate daher vor mindestens drei Monaten abgesetzt worden sein.
Testosteron ist im Blut zum Großteil an
SHBG gebunden. Durch diese Bindung ist Testosteron mehr oder weniger inaktiviert. Nur 1-2 % des Gesamttestosterons liegen als freies oder biologisch aktives Testosteron vor und stehen für die Umwandlung zu
DHT zur Verfügung.
Der freie Androgenindex FAI ist ein einfacher Parameter, der als Maß des tatsächlich biologisch aktiv wirkenden Testosterons gilt:
FAI = Gesamttestosteron (nmol/l) x 100/SHBG (nmol/l) (Norm ≤3,5)
Bei Adipösen ist gerade das SHBG stark erniedrigt und somit liegt dann bei (hoch)normalen Gesamttestosteron bereits eine deutliche Hyperandrogenämie mit erhöhtem FAI vor.
Liegt der
LH-Wert im Normbereich bei deutlich erhöhten DHEAS-Spiegeln (>3 µg/ml)
und ebenfalls erhöhten Prolaktinspiegeln, spricht dies eher für eine vorwiegend
adrenale Ursache und erfordert die Bestimmung des
17-Hydroxyprogesterons (17-OHP). Hier hat sich ein basaler Grenzwert von 2 ng/ml etabliert. Bei einer gestörten Funktion der Nebennieren steht klinisch Hirsutismus im Vordergrund, während Akne und Haarausfall weniger ausgeprägt sind. In diesen Fällen kann zum Ausschluß eines sogenannten "late onset"
adrenogenitalen Syndroms ein ACTH-Test erfolgen. Bei diesem gilt ein 17-Hydroxyprogesteron-Anstieg von >2,5 bei gleichzeitig schwachem Anstieg von Kortisol als Hinweis auf ein Adrenogenitales Syndrom. Anschließend sollte zur definitiven Absicherung der Diagnose eine genetische Untersuchung auf 21-Hydroxylasemangel (Mutationen im 21-Hydroxylase-Gen CYP21A2) erfolgen.
Unabhängig vom Körpergewicht weisen etwa 50 % der Patientinnen eine Störung des Blutzuckerhaushaltes, die sogenannte
Insulinresistenz auf, ca. 20 % eine sogenannte gestörte Glukosetoleranz und bis zu 7,5 % bereits einen manifesten Diabetes mellitus Typ II. Nebenbefundlich können auch eine begleitende
Hyperprolaktinämie, eine
latente Hypothyreose oder eine
Hashimoto-Thyreoiditis auftreten.
Das Anti-Müller-Hormon, abgekürzt
AMH, kann zur Fertilitätsdiagnostik verwendet werden. Es korreliert mit der Funktion der Eierstöcke. Vereinfacht ausgedrückt handelt es sich bei AMH um einen Wert, der von Zellen produziert wird, die die Eizellen unterstützen. Ein AMH-Wert von 1 oder höher ist gut. Es ist ein Marker, der mit dem Alter korreliert. Mit zunehmendem Alter sinkt der AMH-Spiegel der Frau entsprechend dem Verlust an ovarieller Funktionsreserve ab.
Eine Hormondiagnostik soll zwischen dem 2. und 4. Zyklustag bzw. vor der Entwicklung eines dominanten Follikels von >10 mm bei Zyklusstörungen erfolgen, wegen des Anstiegs der adrenalen Androgensekretion
möglichst vor 15 Uhr. Bei Bedarf kann eine Blutung durch die Gabe von z. B. 10 mg Medroxyprogesteronacetat (MPA) über 12-14 Tage eingeleitet werden.
Antibabypillen sollten 12 Wochen zuvor abgesetzt worden sein.
Typische Laborbefunde bei Vorliegen eines PCO-Syndroms:
- Testosteron, evtl. auch Androstendion, erhöht
- SHBG-Spiegel erniedrigt
- LH-Basaltonus erhöht und LH-/FSH-Quotient >1
- Leichte Prolaktinbegleiterhöhungen in bis zu einem Drittel der Fälle
- Insulinresistenz
Insulinresistenz:
Abschätzung durch Messung von Nüchternplasmaglukose und Nüchternseruminsulin und Berechnung des HOMA-Index (Homeostasis-Model-Assessment-Index):
Seruminsulin (nüchtern, in µU/ml) x Plasmaglukose (nüchtern, in mg/dl)
-------------------------------------------------
405
Bewertung:
- <2: normal
- >2 bis 2,5: Verdacht auf Insulinresistenz
- >2,5: Insulinresistenz höchst wahrscheinlich
Ein
oraler Glukosetoleranztest mit 75 g Glukose (oGTT) einschließlich Insulinbestimmung (nüchtern, nach 1 und 2 Stunden) ist bei jeder Patientin zum Ausschluss einer manifesten Glukosestoffwechselstörung bzw. Klärung einer Insulinresistenz sinnvoll. Die Mehrzahl der Patientinnen weist normale basale Insulinwerte auf, welche unter der Stimulation dann aber überproportional ansteigen bzw. keinen zeitgerechten Abfall zeigen, also erst in der Insulin-Verlaufsmessung auffällig werden. Stützt man die Aussage über eine periphere Insulinresistenz allein auf die Bestimmung des sogenannten HOMA-Index fallen dagegen viele Patientinnen nicht auf und werden fälschlicherweise als unauffällig eingestuft.
Gestörte Glukosetoleranz/Diabetes mellitus:
Haben Patientinnen im Rahmen eines oGTT nach 2 Stunden einen Blutzuckerwert zwischen 140 mg/dl und 200 mg/dl, liegt eine gestörte Glukosetoleranz vor. Das bedeutet, dass bei ihnen der Zuckerstoffwechsel bereits gestört ist, sie aber noch keinen Typ-2-Diabetes haben. Dieser würde bei Werten ab 200 mg/dl vorliegen.
Die möglichen Störungen des Stoffwechsels, die mit einem PCO-Syndrom zusammen vorliegen können, können zu einem sogenannten Metabolischen Syndrom führen. Zwei der folgenden drei Kriterien müssen dann zusätzlich zu einer bauchbetonten androiden Adipositas mit einem Tailllenumfang von ≥80 cm nach Definition der International Diabetes Federation (IDF) erfüllt sein:
- Fettstoffwechselstörung (Triglyceride >150 mg/dl, HDL-Cholesterin <50 mg/dl)
- Bluthochdruck (systolisch ≥130 mmHg, diastolisch ≥85 mmHg)
- Blutzucker nüchtern >110 mg/dl
| Klassi-fikation | Erklärung | Kommentar | Körpergewicht/ -bild | Labor |
| FAS I | PCOS ohne metabolische Störung | Gruppe schlanker Patientinnen mit vergrößerten polyfollikulären Ovarien (PFO) und damit erhöhtem AMH-Spiegel. Weiterhin sind Testosteron, LH und der LH-/FSH-Quotient erhöht. Letzteres kann die Selektion des dominanten Follikels blockieren und zu Oligo-Amenorrhoe, Anovulation und damit zur Infertilität führen; das PFO ist z. B. durch die Testosteron-Überproduktion für diese hypothalamo-hypophysäre Störung verantwortlich zu machen. Insgesamt entsteht ein sich gegenseitig störender, dysfunktioneller zentral-ovarieller Regelkreis. Es bestehen keinerlei metabolische Störungen. In der Subgruppe FAS Ib finden sich Frauen mit zusätzlicher adrenaler Hyperandrogenämie. | BMI: schlanke Patientinnen
Ovarien: vergrößerte, polyfollikuläre Ovarien
Oligo-Amenorrhoe, Anovulation, Infertilität |
Testosteron: erhöht
AMH: erhöht LH: erhöht LH-/FSH-Quotient: erhöht DHEAS: erhöht bei FAS Ib Keine metabolischen Störungen |
| FAS II | Late onset AGS, "non-classical congenital adrenal hyperplasia" | Der Ursprung der Hyperandrogenämie ist dominant adrenal, häufig findet sich in dieser Gruppe ein pathologischer ACTH-Stimulationstest oder Dexamethason-Hemmtest bzw. eine CYP21A2-Mutation/-Deletion. Die Ovarien sind normal groß und eher oligofollikulär, das AMH altersentsprechend oder vermindert, LH und der LH-/FSH-Quotient sind normal bis vermindert, Testosteron und/oder DHEAS sind erhöht. Die Subgruppe FAS IIb zeigt zusätzliche ovarielle oder metabolische Störungen, der adrenale Aspekt muss dabei aber im Vordergrund stehen (z. B. bei einer klinisch wirksamen CYP21A2-Mutation). | BMI: unspezifisch
Ovarien: normal groß und eher oligofollikulär |
Testosteron: erhöht
DHEAS: erhöht AMH: niedrig bis normal LH: normal 17-OH-P: meist erhöht ACTH-Test: z. T. pathologich Dexa-Hemmtest: z. T. pathologisch CYP21A2-Gen: häufig Mutation |
| FAS III | PCOS mit metabolischem Syndrom | Diese übergewichtigen bzw. adipösen Frauen weisen ovarielle Charakteristika wie bei FAS I auf; pathognomisch ist hier eine deutliche Senkung des SHBG, wodurch der FAI als Zeichen einer zusätzlichen indirekten Hyperandrogenämie deutlich ansteigt. Weiterhin finden sich metabolische Pathologien, wie Hyperinsulinämie, Hyperlipidämie und/oder Hypertonie bis hin zum Vollbild des metabolischen Syndroms. Die Subgruppe FAS IIIb zeigt zusätzlich eine adrenale Beteiligung oder es liegt eine oligosymptomatische Konstellation vor. | BMI: übergewichtige bzw. adipöse Frauen
Ovarien: vergrößerte polyfollikuläre Ovarien (PFO) |
Testosteron: erhöht
SHBG: niedrig FAI: erhöht AMH: erhöht LH: erhöht LH-/FSH-Quotient: erhöht Insulin: erhöht Lipide: pathologisch DHEAS: z. T. erhöht |
| FAS IV | Non-PCO PCOS | Zu dieser Gruppe werden alle jene Patientinnen subsumiert, die eine hepatisch-metabolische Pathogenese der Hyperandrogenämie aufweisen. Diese Patientinnen sind meist adipös mit androider Fettverteilung, die Ovarien sind sonographisch normal groß oder eher hypoplastisch und oligofollikulär, daher finden sich - anders als bei FAS III - häufig niedrige Testosteron-, AMH- und LH-Serumspiegel. | BMI: adipös imt androider Fettverteilung
Ovarien: normal groß, bei jungen Fauen auch etwas vergrößert und polyfollikulär |
Testosteron: normal
SHBG: meist erniedrigt FAI: meist erhöht AMH:normal bis niedrig LH: normal Insulin: meist erhöht Lipide: meist pathologisch |
| FCA | Idiopathischer Hirsutismus | Frauen mit einer FCA zeigen eine kutane Androgenisierung unterschiedlichen Ausmaßes. Ihre Ovarmorphologie befindet sich meist im Normbereich, auch kleine, oligofollikuläre Ovarien sind möglich, die AMH-Serumkonzentration weist altersentsprechende Werte auf. Diese Frauen zeigen keine Hyperandrogenämie oder metabolische Störungen. Eine Ursache könnte in einer erhöhten kutanen Aktivität der 5α-Reduktase oder einer höheren Sensitivität der kutanen Androgenrezeptoren begründet sein. Bei der Subgruppe FCA b befindet sich zusätzlich eine polyfollikuläre Hyperplasie der Ovarien mit entsprechend erhöhten Werten von AMH und/oder LH. | BMI: unspezifisch
Ovarien: normal groß, bei jungen Fauen auch etwas vergrößert und polyfollikulär Zyklus: unspezifisch Kutane Androgenisierung |
Labor: unauffällig |
Therapeutische Aspekte bei Frauen ohne Kinderwunsch:
Die Applikation von antiandrogen wirksamen Hormonpräparaten steht im Vordergrund. Hierdurch werden die Umbauprozesse im Bereich der Eierstöcke gestoppt und einer möglichen Gebärmutterschleimhautveränderung und dem dann entsprechend erhöhten Risiko eines Gebärmutterschleimhautkrebses bei chronisch fehlendem Eisprung vorgebeugt. Bei Patientinnen mit Verhütungsbedarf wird die Langzeiteinnahme bevorzugt.
Bei Patientinnen ohne Verhütungsbedarf oder Kontraindikationen zur Einnahme hormonaler kombinierter Ovulationshemmer sollten bevorzugt die Präparate mit natürlichen Östrogenen (Estradiol) eingesetzt werden. Liegt ein Metabolisches Syndrom vor, sind bei Übergewicht und bei Gefässveränderungen sogenannte transdermale Östrogene (Gel oder Pflaster, z. B. 50-er E2-Pflaster) den Tabletten vorzuziehen. Estradiol in Tablettenform zeigt nachteilige Effekte auf bestimmte Gerinnungs- und Entzündungsparameter, während sich transdermales Östrogen in dieser Hinsicht neutral verhält. Das Risiko für thromboembolische Ereignisse ist unter transdermalen Östrogenen nicht klinisch relevant erhöht. Als Gestagen kommt das sogenannte Progesteronderivat Chlormadinonacetat (CMA) in Frage. Eine Minimalmaßnahme wäre im Sinne einer Gebärmutterschleimhautkrebsprophylaxe die monatliche zyklische Gabe von 2 mg CMA über jeweils 14 Tage pro Zyklus. Sofern man einen stärkeren suppressiven Effekt auf die hypophysär-ovarielle Achse erreichen will, um damit der Hyperandrogenämie und der Weiterentwicklung des PCOS stärker entgegenzuwirken (vergleichbar dem Effekt eines kombinierten Ovulationshemmers), kann man alternativ das Gestagen in doppelter Ovulationshemmdosis, als 4 mg CMA, verwenden. Der hierdurch meist ausgelöste absolute Estradiolmangel muss dann durch Zusatz eines natürlichen Östrogens ausgeglichen werden. Ob man das Therapieschema durchgehend anwendet oder eine regelmäßige Einnahmepause beider Präparate von vier Tagen im Monat vereinbart (z. B. vom 1. bis 4. des Monats), um dem Endometrium die Möglichkeit zum Abbluten zu geben, ist eine Frage des klinischen Ermessens. Alternativ kann die Patientin auch immer dann, wenn eine Blutung auftritt, vier Tage mit der Medikation pausieren. Eine über vier Tage hinausgehende Pause könnte den Suppressionseffekt auf die hypophysär-ovarielle Achse gefährden (und damit auch die kontrazeptive Sicherheit, die zwar für dieses Schema nicht getestet, aber in Hinblick auf die doppelte Ovulationshemmdosis mit großer Wahrscheinlichkeit gegeben ist). Eine ausreichende Unterdrückung der Hormonproduktion von Hirnanhangdrüse (Hypophyse) und Eierstöcken kann durch Bestimmung von LH, Estradiol und Testosteron im Blut überprüft werden.
Bei ausgeprägtem Hirsutismus oder schwerer Akne ist Cyproteronacetat (CPA) das Gestagen der Wahl. Lässt sich bei schwerer Akne mit mindestens 6monatiger oder bei Hirsutismus mit 12monatiger Behandlung mit den handelsüblichen Präparaten kein Erfolg erzielen, kann die Rezeptorblockade durch Erhöhung der Antiandrogendosis verstärkt werden, indem die Patientin zusätzlich über die ersten 15 Einnahmetage hinweg ein Tablette Androcur®-10 einnimmt. Aufgrund seiner guten Fettlöslichkeit und ausgesprochenen Depotwirkung wird es an den übrigen Tagen nicht eingesetzt. Eine hoch dosierte CPA-Therapie sollte nicht länger als ein Jahr durchgeführt werden, da danach mit keiner weiteren Besserung der Symptomatik mehr gerechnet werden kann. Zu den möglichen Nebenwirkungen der Therapie zählen Müdigkeit, Libidoverlust, Gewichtszunahme, Brustspannen und Schwindel. 3-4 Zyklen, nachdem die Androgenisierungserscheinungen abgeklungen sind, kann bei Patientinnen mit Verhütungsbedarf auf ein hormonell niedriger dosiertes Empfängnisverhütungsmittel umgestellt werden.
Eine Insulinresistenz steigert die ovarielle und adrenale Androgenproduktion und trägt somit zur Entstehung und zum Erhalt eines PCO-Syndroms bei. Durch das Medikament Metformin lassen sich Heißhungerattacken, die aufgrund hoher Insulinspiegel auftreten, und die daraus resultierenden Diätfehler vermindern. Somit unterstützt die Einnahme eine notwendige Gewichtsreduktion. In der vorliegenden Situation wäre dies allerdings ein Off-Label-Use, da Metformin nur zur Therapie eines manifesten Diabetes mellitus zugelassen ist. Es sollte einschleichend dosiert werden: Die Dosis wird in 500 mg-Schritten 1-2wöchentlich gesteigert. Zieldosis, Nebenwirkungen und empfohlene Laborkontrollen werden weiter unten beschrieben. Bei einigen wenigen Patientinnen sinkt darunter zudem der Vitamin-B12-Spiegel.
Glukokortikoide (z. B. 0,25-0,5 mg Dexamethason tgl. abends) sind berechtigt, wenn eine Beteiligung der Nebennierenrinde an der hyperandrogenämischen Störung nachgewiesen ist und die Unterdrückung der Androgene unter Östrogenzufuhr in Kombination mit CPA nicht ausreicht. Die Behandlung wird allerdings durch eine ungewollte Gewichtszunahme (durchschnittlich 4 kg in 4 Monaten) belastet.
Lokalmaßnahmen stellen die Epilierung oder Verwendung einer Creme mit Eflornithin (Vaniqa®) zur Reduktion unerwünschter Gesichtsbehaarung dar. Etwas vereinfacht kann man sagen, dass ein Drittel der Frauen sehr gut auf die Creme anspricht, ein Drittel mittelstark und ein Drittel gar nicht. In welche Gruppe die einzelne Patientin gehört, kann in der Regel bereits nach acht Wochen Anwendung entschieden werden. Als Nebenwirkung werden von etwa 5 % der Frauen Brennen, Stechen und Kribbeln der Haut, sowie akneartiger Hautausschlag angegeben.
Androgenetisch bedingtes Effluvium kann durch eine Lösung mit Minoxidil (Regaine® für Frauen) behandelt werden. Weitere Erläuterungen finden sich im Kapitel Haarausfall.
Bei Akne kommen Vitamin-A-Säure, Benzoylperoxid oder auch Antibiotika zum Einsatz.
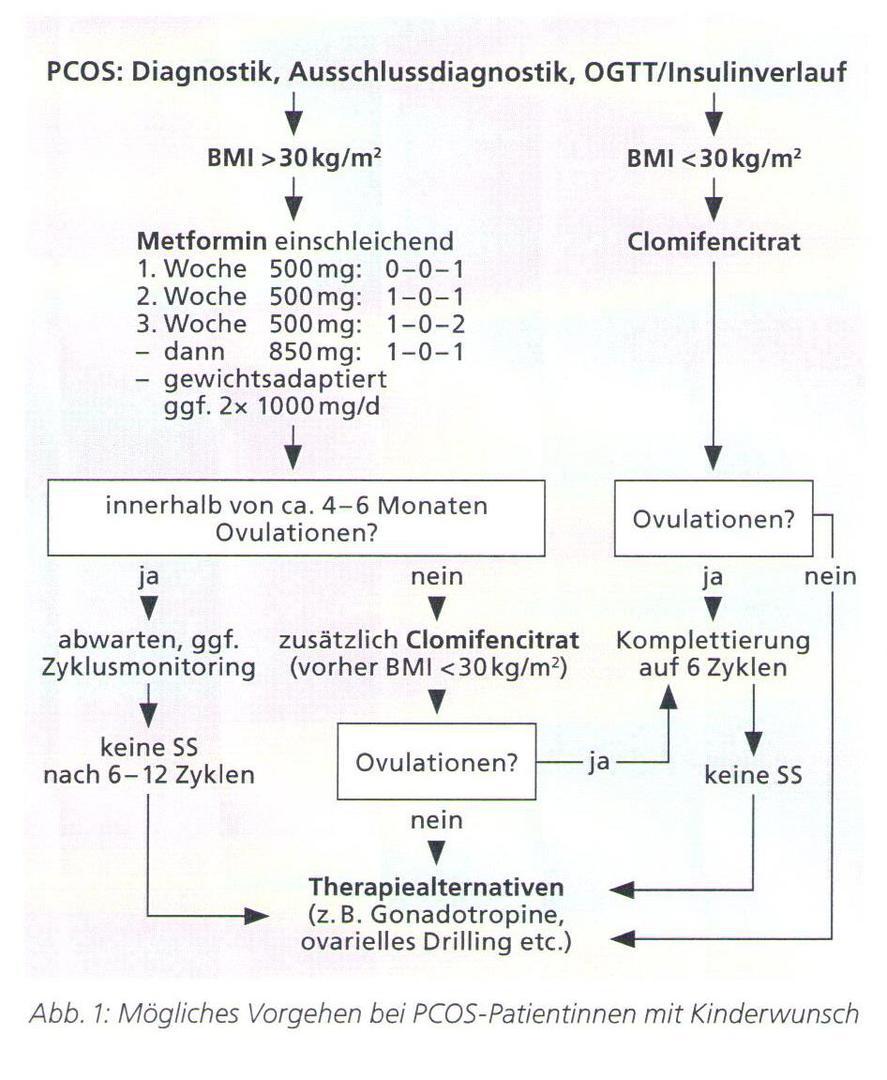
Therapeutische Aspekte bei Frauen mit Kinderwunsch:
Bei erhöhten LH-Basaltonus wird die zwei- bis dreimonatige Einnahme einer Antibabypille vorab empfohlen, um dann direkt nach der letzten Abbruchblutung mit einer Behandlung mit dem Medikament Clomifen beginnen zu können.
Führt eine Stimulationsbehandlung mit Clomifen auch nach Dosiserhöhung auf 100 mg pro Tag nicht zu einem Eisprung und sind ein erhöhter LH-Basaltonus oder eine gleichzeitige Erhöhung des Prolaktins als Störfaktoren ausgeschlossen, muss man mit der Möglichkeit einer Störung des Blutzuckerhaushaltes rechnen, insbesondere bei übergewichtigen Menschen, da Übergewicht bekanntlich zu Insulinresistenz führt. Das Medikament Metformin führt im Idealfall zu einer Zyklusnormalisierung. Als Zieldosis gilt orientierend die Einnahme von 1500 mg Metformin tgl. bei einem BMI bis 25, 1700 mg täglich bis zu einem BMI von 30 und 2000 mg täglich bei noch höherem BMI. Die Zyklusnormalisierung kann nach 3 Monaten überprüft werden. Um ausgeprägte Nebenwirkungen im Magen-Darm-Trakt (Meteorismus, Durchfall) zu vermeiden, sollte die Medikation über 3 Wochen einschleichend dosiert werden unter Kontrolle der Nieren- und Leberwerte (Kreatinin, GOT, GPT, ỵ-GT). Bei der Metformin-Gabe handelt es sich um eine Off-label-Anwendung. Die Langzeitanwendung von Metformin geht zudem mit niedrigeren Vitamin B12-Spiegeln einher, weshalb eine entsprechende Substitution eingeleitet werden sollte. Bei Eintritt einer Schwangerschaft sollte es nicht mehr eingenommen werden, aber auch, wenn seine Wirksamkeit nach spätestens 6 Monaten nicht erkennbar ist.
International gilt in einigen Ländern Letrozol inzwischen als First-Line-Medikament zur Stimulationsbehandlung. Die Einnahme folgt dem gleichen Muster wie bei Clomifen: fünf Tage 2,5 mg Letrozol z. B. vom zweiten bis siebten Zyklustag. Da die Halbwertzeit mit 45 Stunden sehr gering ist, sollte zum Zeitpunkt der Ovulation kein Letrozol mehr im Körper sein, so dass es aufgrund der Einnahme nicht zu Fehlbildungen kommen dürfte. In Deutschland gibt es hierfür bislang keine Zulassung.
Gonadotropine werden üblicherweise als Second-Line-Therapie eingesetzt, sofern Clomifen bzw. Letrozol nicht zum gewünschten Erfolg geführt haben. Es werden Dosierungen von 25-75 IU/Tag eingesetzt. Gewöhnlich genügt eine Behandlung von 7 bis 14 Tagen z. B. mit Puregon®. Ist die Behandlung beendet, wird der Eisprung wird mit der Verabreichung von humanem Choriongonadotropin (hCG) herbeigeführt.
Bei Versagen von First- und Second-Line-Behandlungen zur Auslösung eines Eisprungs kann eine künstliche Befruchtung (IVF) als Drittlinien-Therapieoption erwogen werden. Hierunter besteht ein erheblich erhöhtes Risiko für ein ovarielles Überstimulationssyndrom.
Die Oberflächenbehandlung polyzystischer Ovarien (Stichelung, ovarian drilling) im Rahmen einer Bauchspiegelung ist eine mögliche Alternative zur künstlichen Befruchtung für die Fälle, bei denen medikamentös keine Schwangerschaft erreicht werden konnte.
Differentialdiagnosen:
Late-onset AGS (21-Hydroxylase-Mangel):
- Basales 17-OH-Progesteron > 6 nmol/i
- ACTH-Test: 17-OH-Progesteron > 10 nmol/l
- Nachweis einer 21-Hydroxylase Mutation
Hyperthekosis ovarii:
- Hyperandrogenämie ausgeprägter als bei PCOS
- Sonographisch lilateral normale oder leicht vergrößerte Ovarien mit Zunahme des ovariellen Stromas, weniger Zysten im Vergleich zum PCOS
Androgen-produzierender Tumor:
- Ovar: Gesamt-Testosteron > 5,2 nmol/l und pathologischer Ultraschall der Eierstöcke
- Nebenniere: Gesamt-Testosteron > 5,2 nmol/l, unauffälliger Ultraschall der Eierstöcke, auffälliges CT der Nebennieren oder DHEAS > 18,9 µmol/l und auffälliges CT der Nebennieren
Schwere Insulinresistenz:
- HOMA-Index > 2,5
Medikamente:
- Hirsutismus: Danazol, Androgene, Anabolika
- Effluvium: Antikoagulanzien, Captopril, Cholesterinsenker, Cimetidin, Colchizin, Schwermetalle, Hormone, Isoretinoin, Ketokonazol, Lithium, Penicillamin, Propanolol, Valproat, Spironolacton
- Akne: Glukokortikoide, Phenytoin, Lithium, Isoniazid, EGFR-Inhibitoren, Jodid, Bromid, Androgene, Gestagene mit androgener Partialwirkung, Corticotropin, Cyclosporin, Disulfiram, Psoralens, Thiourea, Vitamin B2, B6 und B12, Azathioprin
Hyperprolaktinämie:
- Prolaktin erhöht
Cushing-Syndrom:
- Cortisol erhöht
Idiopathisch:
- Alle anderen Ursachen wurden ausgeschlossen